Synthèse du Bromoéthane
Calculer les quantités de réactifs, le réactif limitant, la masse théorique et le rendement d'une synthèse organique.
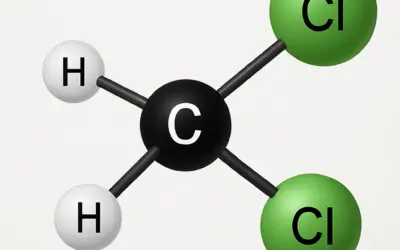
Le bromoéthane (CH\(_3\)CH\(_2\)Br), également connu sous le nom de bromure d'éthyle, est un halogénoalcane liquide utilisé comme solvant, anesthésique local (anciennement) et réactif en synthèse organique. Une méthode courante pour le préparer est la réaction de substitution nucléophile entre l'éthanol (CH\(_3\)CH\(_2\)OH) et l'acide bromhydrique (HBr).
L'équation de la réaction est :
Le rendement d'une synthèse est une mesure de son efficacité. Il est défini comme le rapport entre la masse de produit réellement obtenue (\(m_{obtenue}\)) et la masse de produit que l'on aurait théoriquement dû obtenir (\(m_{theorique}\)), si la réaction était totale et sans pertes :
Données du Problème
On souhaite synthétiser du bromoéthane.
- Volume d'éthanol (CH\(_3\)CH\(_2\)OH) utilisé : \(V_{ethanol} = 25.0 \text{ mL}\)
- Masse volumique de l'éthanol : \(\rho_{ethanol} = 0.789 \text{ g/mL}\)
- L'acide bromhydrique (HBr) est utilisé en excès.
- Masse de bromoéthane (CH\(_3\)CH\(_2\)Br) obtenue expérimentalement : \(m_{bromoethane\_exp} = 38.5 \text{ g}\)
Masses molaires atomiques :
- Carbone (C) : \(M(C) = 12.0 \text{ g/mol}\)
- Hydrogène (H) : \(M(H) = 1.0 \text{ g/mol}\)
- Oxygène (O) : \(M(O) = 16.0 \text{ g/mol}\)
- Brome (Br) : \(M(Br) = 79.9 \text{ g/mol}\)
Questions
- Calculer la masse molaire de l'éthanol (CH\(_3\)CH\(_2\)OH).
- Calculer la masse molaire du bromoéthane (CH\(_3\)CH\(_2\)Br).
- Calculer la masse d'éthanol (\(m_{ethanol}\)) utilisée.
- Calculer la quantité de matière initiale d'éthanol (\(n_{ethanol, initial}\)).
- L'acide bromhydrique étant en excès, quel est le réactif limitant ?
- En utilisant l'équation de la réaction, déterminer la quantité de matière théorique de bromoéthane (\(n_{bromoethane, theorique}\)) que l'on pourrait obtenir.
- Calculer la masse théorique de bromoéthane (\(m_{bromoethane, theorique}\)) correspondante.
- Calculer le rendement (\(\eta\)) de cette synthèse.
Correction : Synthèse du Bromoéthane
1. Masse Molaire de l'Éthanol (CH\(_3\)CH\(_2\)OH ou C\(_2\)H\(_6\)O)
Somme des masses molaires atomiques.
Données :
\(M(C) = 12.0 \text{ g/mol}\)
\(M(H) = 1.0 \text{ g/mol}\)
\(M(O) = 16.0 \text{ g/mol}\)
La masse molaire de l'éthanol est \(M(C_2H_6O) = 46.0 \text{ g/mol}\).
2. Masse Molaire du Bromoéthane (CH\(_3\)CH\(_2\)Br ou C\(_2\)H\(_5\)Br)
Somme des masses molaires atomiques.
Données :
\(M(C) = 12.0 \text{ g/mol}\)
\(M(H) = 1.0 \text{ g/mol}\)
\(M(Br) = 79.9 \text{ g/mol}\)
La masse molaire du bromoéthane est \(M(C_2H_5Br) = 108.9 \text{ g/mol}\).
Quiz Intermédiaire
3. Masse d'Éthanol (\(m_{ethanol}\)) Utilisée
On utilise la relation \(m = \rho \times V\).
Données :
\(V_{ethanol} = 25.0 \text{ mL}\)
\(\rho_{ethanol} = 0.789 \text{ g/mL}\)
La masse d'éthanol utilisée est \(m_{ethanol} \approx 19.7 \text{ g}\).
4. Quantité de Matière Initiale d'Éthanol (\(n_{ethanol, initial}\))
On utilise la formule \(n = m/M\).
Données :
\(m_{ethanol} = 19.725 \text{ g}\)
\(M(C_2H_6O) = 46.0 \text{ g/mol}\)
La quantité de matière initiale d'éthanol est \(n_{ethanol, initial} \approx 0.429 \text{ mol}\).
Quiz Intermédiaire
5. Réactif Limitant
L'énoncé précise que l'acide bromhydrique (HBr) est utilisé en excès.
Si HBr est en excès, cela signifie que l'éthanol sera entièrement consommé et limitera la quantité de produit formé.
L'éthanol (CH\(_3\)CH\(_2\)OH) est le réactif limitant.
6. Quantité de Matière Théorique de Bromoéthane (\(n_{bromoethane, theorique}\))
On utilise l'équation de la réaction : \(CH_3CH_2OH + HBr \rightarrow CH_3CH_2Br + H_2O\). Les coefficients stœchiométriques de l'éthanol et du bromoéthane sont de 1.
Données :
\(n_{ethanol, initial} \approx 0.4288 \text{ mol}\) (réactif limitant)
D'après la stœchiométrie 1:1, la quantité de matière théorique de bromoéthane est égale à la quantité de matière initiale d'éthanol :
La quantité de matière théorique de bromoéthane est \(n_{bromoethane, theorique} \approx 0.429 \text{ mol}\).
Quiz Intermédiaire
7. Masse Théorique de Bromoéthane (\(m_{bromoethane, theorique}\))
On utilise la formule \(m = n \times M\).
Données :
\(n_{bromoethane, theorique} \approx 0.4288 \text{ mol}\)
\(M(C_2H_5Br) = 108.9 \text{ g/mol}\) (calculé à l'étape 2)
La masse théorique de bromoéthane est \(m_{bromoethane, theorique} \approx 46.7 \text{ g}\).
8. Rendement (\(\eta\)) de la Synthèse
Le rendement est le rapport de la masse obtenue expérimentalement sur la masse théorique.
Données :
\(m_{bromoethane\_exp} = 38.5 \text{ g}\)
\(m_{bromoethane, theorique} \approx 46.696 \text{ g}\)
Le rendement de la synthèse du bromoéthane est \(\eta \approx 82.4\%\).
Quiz : Testez vos connaissances !
Glossaire des Termes Clés
Bromoéthane (CH\(_3\)CH\(_2\)Br) :
Halogénoalcane, également appelé bromure d'éthyle.
Éthanol (CH\(_3\)CH\(_2\)OH) :
Alcool primaire, principal composant des boissons alcoolisées et utilisé comme solvant ou carburant.
Acide Bromhydrique (HBr) :
Acide fort, solution aqueuse de bromure d'hydrogène.
Synthèse Chimique :
Processus de préparation d'un composé chimique à partir de réactifs.
Masse Molaire (M) :
Masse d'une mole d'une substance (en g/mol).
Quantité de Matière (n) :
Nombre de moles d'une substance (en mol).
Réactif Limitant :
Réactif qui est entièrement consommé en premier dans une réaction chimique et qui détermine la quantité maximale de produit formé.
Masse Théorique :
Masse maximale de produit qui pourrait être obtenue si la réaction était totale et sans pertes, basée sur le réactif limitant.
Rendement (\(\eta\)) :
Rapport (souvent en pourcentage) entre la masse de produit réellement obtenue et la masse théorique.
Masse Volumique (\(\rho\)) :
Masse d'une substance par unité de volume (ex: g/mL).
Questions d'Ouverture ou de Réflexion
1. Quelles sont les étapes typiques d'une synthèse organique en laboratoire après la réaction elle-même (par exemple, isolement, purification du produit) ? Comment ces étapes peuvent-elles affecter le rendement ?
2. Le bromoéthane est un composé volatil. Quelles précautions faudrait-il prendre lors de sa manipulation et de sa synthèse ?
3. La réaction de l'éthanol avec HBr est une réaction de substitution nucléophile. Quel est le mécanisme général de ce type de réaction ?
4. Si l'acide bromhydrique n'était pas en excès, comment déterminerait-on le réactif limitant ?
5. Recherchez d'autres méthodes de synthèse des halogénoalcanes.
D’autres exercices de chimie terminale:







0 commentaires